潘跃银传授:揭秘T-DM1的奇特构造设想和感化机造,瞻望将来新打破
*仅供医学专业人士阅读参考

T-DM1是若何设想的呢?将来的摸索标的目的又有哪些?乳腺癌是女性最常见的恶性肿瘤,全球每年新发病例约226万例,占所有女性新发癌症总数的24.5%[1]。HER2阳性乳腺癌临床占比20%摆布,预后较差。一系列研究表白,抗HER2治疗能显著改善患者预后[2]。此中HER2靶向的抗体药物偶联物(ADC)更是为HER2阳性乳腺癌治疗范畴创始了崭新场面,T-DM1做为首个获批治疗乳腺癌的ADC药物,其构造设想和感化机造有哪些独到之处,且看潘跃银传授为您揭秘。T-DM1的奇特构造设想和感化机造
T-DM1之“T”:曲妥珠单抗
潘跃银指出,T-DM1由曲妥珠单抗与DM1(美登素衍生物)通过不变硫醚毗连子偶联而成,人源化的曲妥珠单抗是一种IgG1型抗体,它与细胞外表表达的HER2具有很高的亲和性而且有效阐扬人源化抗体按捺HER2过表达细胞生长的才能。T-DM1保留了曲妥珠单抗感化,能够按捺HER2受体信号转导,同时诱导抗体依赖细胞介导的细胞毒性感化(ADCC),按捺HER2过表达的人乳腺癌细胞中HER2胞外域的脱落[3]。而且体外研究显示,T-DM1的ADCC感化强于曲妥珠单抗,对靶细胞毒性感化更强[4]。T-DM1之“DM1”:强效抗微管药物
大量临床前和临床研究表白,曲妥珠单抗与感化于微管的细胞毒药物结合利用可以阐扬协同感化。DM1能有效按捺微管卵白聚合,进而阻滞细胞有丝团结,招致细胞凋亡。综合考虑感化机造和感化效能,DM1是一类可以很好地与曲妥珠单抗停止偶联的细胞毒分子[3,5]。且研究表白,DM1比目前临床利用的化疗药物的抗肿瘤活性强25-4000倍(比紫杉醇强25-500倍,比阿霉素强100-4000倍)[6]。
图1. 曲妥珠单抗和T-DM1的感化机造T-DM1均匀偶联3.5个DM1:抱负DAR
T-DM1中均匀每个抗体分子可以照顾3.5个DM1效应分子,具有比力抱负的药物抗体比(DAR)。虽然理论上较高的DAR值对应更强的药效,然而跟着DAR增加,ADC的疏水性以及抗体分子天然构造遭到的影响也会增加,最末招致药物分子的肃清率增高,体内半衰期降低[7,8]。一项研究[9]针对MMAE(甲基澳瑞他汀E)与cAC10(抗CD30+的单克隆抗体)通过半胱氨酸偶联产生的具有差别DAR值的ADC药物停止了摸索(按照MMAE载药量的差别,别离简称E2、E4、E8),针对CD30+系肿瘤细胞在体外测试了E2、E4、E8的抗肿瘤活性,成果表白体外效力跟着载药量的增大而加强(IC50值E8<E4<E2)。研究还通过Karpas-299异种移植瘤小鼠模子,考察了ADC药物的更大耐受剂量(MTD)和药代动力学特征。在不异抗体剂量下,E4显示出与E8相当的体内抗肿瘤活性,而E2需要更高的剂量才气显示杀伤效力。且E2、E4、E8的MTD跟着载药量增加而削减,别离为≥250mg/kg、100mg/kg、50mg/kg。那些申明跟着DAR的增加,ADC药物并未获得更好的疗效。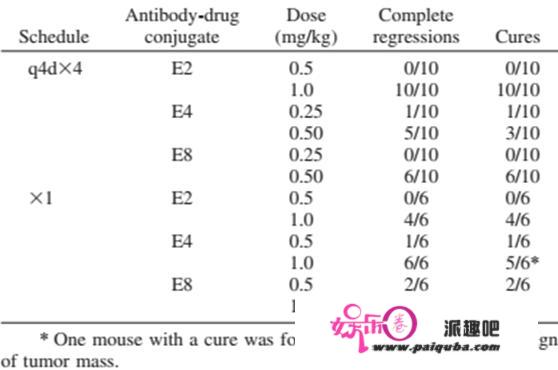
图2. 差别载药量ADC药物的体内活性而且在药代动力学特征方面,该研究表白ADC药物的表露量跟着载药量的削减而增加,药物肃清率跟着载药量的增加而进步(别离从cAC10的3.8mL/day/kg逐渐增加到4.4、6.0和19.2mL/day/kg)。那也解释了E8比拟E4在体内并没有像体外一样表示出更高的活性。
图3. 差别载药量ADC药物的肃清速度ADC药物加速肃清的原因在于疏水性的增加[10],疏水性是影响小分子药物整体理化特征的重要因素,固然疏水性的增加凡是会招致体外效力的进步,但它也陪伴着消融度差、代谢不不变和非特异性脱靶效应等风险的增加[11]。DAR越高,抗体中潜在的偶联位点被占据的比例越高,以链间半胱氨酸偶联为例,那意味着完好二硫键的削减,会招致ADC分子疏水性增加,使得ADC分子发作聚集的敏感性进步。因而,关于某些DAR高的ADC药物而言,其抗体分子完好性被毁坏的同时,更容易被肃清体外[11,12]。潘跃银传授进一步指出,总之,当DAR过低时,未连系的抗体一般不参与抗肿瘤活性,凡是与ADC合作抗原连系。当DAR大于4时,ADC大量聚集可招致药物活性降低、肝毒性增加。那就解释了大大都ADC的DAR在3-4之间,即3-4个药物分子均匀负载于一个抗体上。由此,T-DM1 DAR确实定,既要包管未偶联载药的裸抗体所占比例最小化,以降低裸抗体与ADC的合作反响。而且偶联之后得到的ADC应尽量连结与裸抗体类似的疏水性量,以制止产品因为药代动力学性量改动而招致的半衰期降低[13,14]。此外,ADC的更佳DAR还与有效荷载的效力有关[8],而差别有效载荷效力相差较大,拓扑异构酶Ⅰ按捺剂的效力比拟微管卵白按捺剂和毁坏DNA的烷化剂弱10-100倍[15],那也提醒有效载荷效力较差的ADC药物可能需要相对较高的DAR,以包管足够的抗肿瘤活性。因而,颠末稳重考虑,T-DM1的DAR值为3.5,以在较低裸抗体残留的前提下具有较高的生物活性[16,17]。T-DM1之“-”:不变的硫醚毗连子
潘跃银传授指出,毗连子的不变性关于ADC药物的整体毒副感化、药代动力学性量以及治疗指数均有影响。抱负的毗连子,能制止ADC在抵达靶细胞之前过早地释放出效应分子,引起轮回系统毒性对一般组织细胞形成的杀伤性。当ADC内化进入肿瘤细胞后,又必需包管效应分子在靶细胞内的有效释放。T-DM1接纳不成裂解的硫醚毗连子,不成裂解毗连子与可裂解毗连子比拟的一大优势即是在轮回系统中具有优良的不变性[5,13,14]。日本一项关于T-DM1治疗转移性乳腺癌的I期药代动力学研究显示,血浆中游离DM1程度极低[18]。提醒T-DM1的硫醚毗连子不变存在,且毒性可控。
图4. T-DM1的硫醚毗连子T-DM1没有“傍观者效应”:包管平安性
潘跃银传授强调,值得存眷的是,ADC对一般细胞的毒性可通过靶点依赖性和非靶点依赖性机造发作,此中非靶点依赖性细胞毒性最重要的考虑因素是毗连子的化学性量。美登素衍生物类ADC最后设想为含有二硫键的毗连子,该战略假定,一旦ADC与细胞外表受体连系,ADC与受体构成的复合物将被内化并转运至内吞室,在该内吞室内被充实复原以释放美登素衍生物。但事与愿违,尝试数据表白,核内体和溶酶体的氧化电位限造了含二硫键的ADC在细胞内的有效裂解。那些研究成果以及关于药代动力学和耐受性改善的其他察看成果,配合促进了将含有环己烷羧酸酯间隔基的硫醚毗连子纳入曲妥珠单抗ADC的选择。其他研究表白,一旦T-DM1被内化,其抗体部门就会被快速降解,构成赖氨酸残基-毗连子-DM1(lysine-Nε-MCC-DM1)做为杀灭肿瘤细胞的效应分子。因为该复合物是两性离子,不容易穿过临近一般细胞的量膜,没有所谓的“傍观者效应”,不会对旁邻一般细胞产生杀伤感化。因而,也不会呈现非靶点依赖性的毒副感化,总体平安性优良[3,6]。
图5. T-DM1的细胞内转运过程T-DM1接纳赖氨酸残基偶联:不毁坏抗体分子构造,包管不变性
此外,ADC的抗体偶联位点次要有赖氨酸残基中的氨基和半胱氨酸链间二硫键被复原得到的巯基。因为美登素类衍生物具备巯基活性位点,出于选择性的考虑,其毗连子一般选择与抗体赖氨酸残基上的氨基相连。而且T-DM1接纳赖氨酸的氨基与活化的羧酸酯毗连子通过酰胺键毗连不会毁坏抗体分子构造,也能包管ADC药物的不变性[14,19]。
图6. T-DM1的偶联体例T-DM1治疗HER2阳性晚期乳腺癌表示优良
潘跃银传授暗示,基于T-DM1奇特的构造设想和感化机造,不论是临床前仍是临床研究,T-DM1都表示出较强的抗肿瘤活性。而且成为首个获批治疗乳腺癌的ADC药物。其关键Ⅲ期EMILIA临床试验共招募991例HER2阳性晚期乳腺癌患者随机分配至T-DM1组和拉帕替尼+卡培他滨组,成果显示,T-DM1组的中位无停顿保存期(mPFS)和中位总保存期(mOS)均较拉帕替尼+卡培他滨组耽误(mPFS:9.6个月vs 6.4个月,HR=0.65,P<0.001;mOS:30.9个月vs 25.1个月,HR=0.68,P<0.001),ORR也明显进步(43.6% vs 30.8%,P<0.001),且3-4级治疗相关不良事务(TRAEs)发作率更低[20]。此外,TH3RESAⅢ期临床研究纳入602例HER2阳性晚期乳腺癌患者随机分配至 T-DM1 组和医师选择治疗计划组,成果显示T-DM1组mPFS、mOS均优于医师选择治疗计划组(mPFS:6.2个月 vs 3.3个月,HR=0.528,P<0.0001;mOS:22.7个月 vs 15.8个月,HR=0.68,P=0.0007)[21,22]。基于上述临床试验的显著疗效,2013年FDA批准T-DM1治疗既往承受过紫杉类和曲妥珠单抗(TH计划)的HER2阳性转移性乳腺癌,2021年6月该适应证在中国获批上市,正式开启了我国晚期乳腺癌ADC治疗新时代。T-DM1将来摸索不竭,值得等待
最初,潘跃银传授暗示,迄今为行,T-DM1相关的临床研究有100多项。T-DM1证明了在乳腺癌中的卓越疗效和可控的平安性,目前已成为HER2阳性乳腺癌晚期二线以及早期乳腺癌新辅助治疗后有残留病灶患者的尺度治疗,将来T-DM1做为一线或新辅助治疗的定位亟待更多的摸索。相关的预测疗效和耐药的生物标记物以及其他评估办法的研究也在积极开展。而且T-DM1结合治疗战略的一系列研究已有阶段性功效披露,所有那些停顿都将进一步鞭策并优化T-DM1的临床应用。同时,T-DM1在其他恶性实体瘤如肺癌、胃癌等的临床试验也在开展,T-DM1潜在的治疗活性还有望延伸至乳腺癌以外的实体瘤。总的来说,T-DM1的应用前景一片光亮,而且做为HER2靶向ADC药物的“领航者”,对后续药物的研发也起着庞大的指引感化[23]。专家简介
潘跃银 传授
中国科学手艺大学附一院主任医师、传授、博士生导师、博士后指点教师、江淮名医
115财产团队带头人
肿瘤教研室主任
安徽省肿瘤病院副院长
药物临床研究机构施行主任
安徽省肿瘤量量控造中心副主任
任中国临床肿瘤协会(CSCO)理事
CSCO转化医学专委会副主任委员
CSCO心脏平安专委会副主任委员
CSCO肺癌专家委员会常委
CSCO乳腺癌专家委员会常委
中国医师学会肿瘤分会全国委员
中国医师学会肿瘤多学科专委会常委
国度癌症中心乳腺癌专家委员会成员
安徽临床肿瘤学会理事长
安徽省抗癌协会副理事长
中国临床肿瘤协会(CSCO)免疫专家委员会委员等
安徽省医学会乳腺病分会侯任主任委员
安徽省抗癌协会乳腺癌专委会主任委员等
获安徽省科技前进一等奖,以第一或通信做者颁发SCI50余篇,包罗Nature cell biology、 ACS NANO、JTO、CCR等
参考文献:[1]Ferlay J, Colombet M, Soerjomataram I, et al. Cancer statistics for the year 2020:An overview[J]. Int J Cancer,2021.DOI:10.1002/ijc.33588.[2]中国临床肿瘤学会乳腺癌专家委员会, 中国抗癌协会乳腺癌专业委员会. 人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识(2021版)[J]. 中华医学杂志, 2021, 101(17):6.[3] Barok M, Joensuu H, Isola J. Trastuzumab emtansine: mechanisms of action and drug resistance. Breast Cancer Res. 2014 Mar 5;16(2):209.[4]Junttila TT, Li G, Parsons K, et al. Trastuzumab-DM1 (T-DM1) retains all the mechanisms of action of trastuzumab and efficiently inhibits growth of lapatinib insensitive breast cancer. Breast Cancer Res Treat. 2011 Jul;128(2):347-56.[5]周磊, 张国宁, 王菊仙,等. 美登素类抗体药物偶联物研究停顿[J]. 中国新药杂志, 2016(22):2521-2530.[6]LoRusso PM, Weiss D, Guardino E, et al. Trastuzumab emtansine: a unique antibody-drug conjugate in development for human epidermal growth factor receptor 2-positive cancer. Clin Cancer Res. 2011 Oct 15;17(20):6437-47.[7]Conilh L, Fournet G, Fourmaux E, et al. Exatecan Antibody Drug Conjugates Based on a Hydrophilic Polysarcosine Drug-Linker Platform. Pharmaceuticals (Basel). 2021 Mar 9;14(3):247.[8]墨梅英. 抗体药物偶联物:肿瘤治疗范畴的"魔术枪弹"[J]. 药学停顿, 45(3):6.[9] Hamblett KJ, Senter PD, Chace DF, et al. Effects of drug loading on the antitumor activity of a monoclonal antibody drug conjugate. Clin Cancer Res. 2004 Oct 15;10(20):7063-70.[10]Lyon RP, Bovee TD, Doronina SO, et al. Reducing hydrophobicity of homogeneous antibody-drug conjugates improves pharmacokinetics and therapeutic index. Nat Biotechnol. 2015 Jul;33(7):733-5.[11]Buecheler JW, Winzer M, Tonillo J, et al. Impact of Payload Hydrophobicity on the Stability of Antibody-Drug Conjugates. Mol Pharm. 2018 Jul 2;15(7):2656-2664.[12]Pysz I, Jackson PJM, Barlow DJ, et al. UPLC-based assay to assess the hydrophobicity of Antibody-Drug Conjugate (ADC) payloads. J Chromatogr B Analyt Technol Biomed Life Sci. 2020 Jun 1;1146:122075.[13]杨跃梅, 张伯彦, 黎燕,等. 靶向抗肿瘤抗体-药物偶联物研究停顿[J]. 国际药学研究杂志, 2014, 41(1):45-50.[14]王彦明. 美登素类抗体药物偶联物研究停顿[J]. 国际药学研究杂志, 2016(43):410-419.[15]Conilh L, Fournet G, Fourmaux E, et al. Exatecan Antibody Drug Conjugates Based on a Hydrophilic Polysarcosine Drug-Linker Platform. Pharmaceuticals (Basel). 2021 Mar 9;14(3):247.[16]Wakankar AA,Feeney MB,Rivera J,et al. Physicochemical stability of the antibody- drug conjugate trastuzumab- DM1:changes due to modification and conjugation processes. Bio⁃conjug Chem,2010,21(9):1588-1595.[17]Wakankar A,Chen Y,Gokarn Y,et al. Analytical methods for physicochemical characterization of antibody drug conjugates. MAbs,2011,3(2):161-172.[18]Yamamoto H, Ando M, Aogi K, et al. Phase I and pharmacokinetic study of trastuzumab emtansine in Japanese patients with HER2-positive metastatic breast cancer. Jpn J Clin Oncol. 2015 Jan;45(1):12-8.[19]李明莹, 汪琳, 马宁宁. 定点偶联手艺在抗体药物偶联物中的应用[J]. 药学停顿, 45(3):8.[20]Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2 positive advanced breast cancer. N Engl J Med, 2012, 367(19):1783⁃1791.[21]Krop IE, Kim SB, González-Martín A, et al. TH3RESA study collaborators. Trastuzumab emtansine versus treatment of physician's choice for pretreated HER2-positive advanced breast cancer (TH3RESA): a randomised, open-label, phase 3 trial. Lancet Oncol. 2014 Jun;15(7):689-99.[22]Krop IE, Kim SB, Martin AG, et al. Trastuzumab emtansine versus treatment of physician's choice in patients with previously treated HER2-positive metastatic breast cancer (TH3RESA): final overall survival results from a randomised open-label phase 3 trial. Lancet Oncol. 2017 Jun;18(6):743-754.[23]黎立喜, 马飞. 恩美曲妥珠单抗在乳腺癌中的临床研究停顿[J]. 中华肿瘤杂志, 43(1):6.
*此文仅用于向医学人士供给科学信息,不代表本平台概念




我来回答